特別WEBコラム 新型コロナウィルス禍に学ぶ応用物理 イオン電流 ナノポアと機械学習を用いたウイルス検査 筒井真楠,鷲尾隆,川合知二 大阪大学
1. まえがき
新型コロナウイルス(COVID-19)が猛威を振るっている.そして世界規模での感染拡大が収束しない中,浮き彫りになってきているのが,新型ウイルスに適した検査技術の欠如だ1).これまでのウイルス検査では,抗原抗体反応を利用したイムノクロマト法が主流であり,この手法をベースにした検査キットは,実に迅速・安価に特定のウイルスを検出できた.毎年季節性インフルエンザが流行する時期に,病院で感染症検査に使われているのもこの検査キットである.その仕組みは,基板表面にウイルスの表面タンパクと特異的に吸着する抗体分子を固定し,唾液や鼻腔液中にある特定のウイルスだけをそこでトラップ・検出する,というものである.しかし,今回のような新型ウイルスでは,ウイルス表面のタンパク質が従来のウイルスと異なり,新型ウイルスに適用できるキットを開発するためにはまず抗体分子を発見しなければならず,膨大な開発時間・コストが必要になる.
それに対し,ウイルスのゲノムからその種類を同定するPCR(Polymerase Chain Reaction)検査は,新型ウイルスにも適用でき,現在唯一有効な検査法として用いられている.だが,この手法では検査結果が出るまで一般に数時間から数日を要し,またその検査精度も低く2)偽陰性が懸念される.我々が実際に目にしてきているとおり,これではウイルス感染の速度に対応できず,封じ込め対策も遅れ,感染拡大を免れることが難しい.
一方,我々はこれまで新型ウイルスにも対応可能な新しい検査技術として,ナノポアセンサ技術の開発を進めてきた.この技術は抗体分子を必要とせず,単一ウイルスをミリ秒で検出可能な動作原理であることから,現在求められている超迅速・高感度なウイルスセンサを可能にするものである.本技術の内容と将来性について以下に紹介する.
2. ナノポアとは
ナノポアの「ナノ」は0.000000001,「ポア」は細孔を意味する.つまり単なる穴なわけであるが,我々が開発したのはその寸法・形状が半導体技術の加工精度(5 nm)で自在かつ精密に作られた極微細孔である3) 4).その作製プロセスは次のとおりである.基板は表面が厚さ数十nmのSiNx膜で被覆されたSiウェーハである.まず,KOHによるウェットエッチングによってシリコン層を部分的に除去し,大きさ100 µmのSiNxのメンブレン(自立した薄膜)を形成する.そして,電子線描画法により,メンブレン上に用途に応じた大きさのナノポアを描画する(例えばウイルス検出では300 nm).現像後に残るレジスト層をマスクとして,反応性イオンエッチング(CHF3)によりSi0Nxを掘削することでナノポアを開口させる.
3. 低アスペクト比ナノポアセンサ
ナノポアセンサでは,物質がナノポアを通過する際に生じる細孔内のイオン輸送変化を測定する.実際には,ナノポアを生理食塩水などの電解質液で満たし,Ag/AgCl電極を使ってDC電圧を加え,その結果生じるイオン電流を計測する.ここで,電極間のイオン輸送にとってナノポアが大きな抵抗となるため,印可電圧は細孔部に集中し,観測されるイオン電流はナノポア内のイオン輸送状態に応じて敏感に変化する.同時に,液中に帯電した物質があれば,ナノポア付近に生じる強力な電場(通常数十kV/mレベル)を感じ,瞬時にナノポア内を電気泳動するようになる.このとき,ナノポア内のイオン輸送はその物質によって一瞬妨げられることになり,イオン電流はパルス状の変化を見せる.すなわち,このパルス信号を観測することで,ナノポアを通過する粒子の数が測定可能になるわけである.
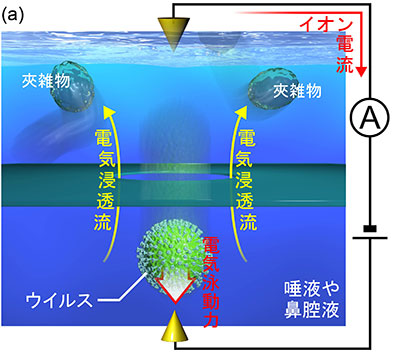
実はこの原理は,コールターカウンタと呼ばれ,粒子の体積を測定するセンサとしてすでに実用されているものである.しかしウイルスのように大きさや形状が似通ったもの(例えばA型とB型のインフルエンザウイルスは電子顕微鏡でも判別が難しいほど類似したナノ粒子)の検出・識別には適用が難しいと予測された.そこで我々はナノテクノロジーを駆使して,低アスペクト比ナノポア3) 4)を開発した(アスペクト比 = ナノポアの深さ/直径).このセンサでは,イオン電流が物質の体積だけでなく,形状5)や表面電荷密度6),質量7)といったさまざまな物理特性に対して敏感になる.この工夫により,例え大きさや形状が似通ったウイルスのような物質であっても,イオン電流パルスの波形からその種類が同定可能となった.

4. ナノポアセンサと機械学習によるウイルス検査
ウイルス識別のための集積ナノポアセンサも開発し8) 9) 10) 11),実際に鶏卵や細胞で培養したインフルエンザやコロナウイルスなどのさまざまなウイルスについて1ウイルス検出が可能になった6) 11).しかしその一方で,従来のデータ解析ではせいぜい電流パルスの波高や波幅しか扱えず,イオン電流波形に複雑に反映されるウイルスの多様な物理特性を正確に見分けるには極めて不十分であった.
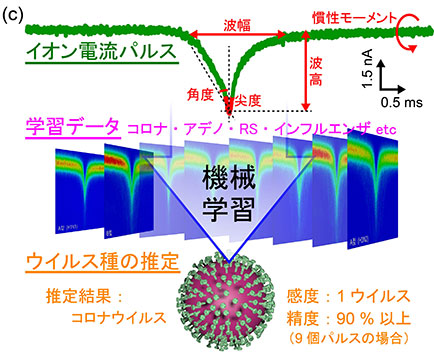
そこで,機械学習による波形解析を導入した12).電流パルスに反映されるウイルスのさまざまな特性(ウイルス間のバラつきを含む)を網羅するために,波高・波幅・尖度・慣性などの複数特徴量を採用した.そしてこれらをイオン電流の時系列データとランダムに組み合わせて特徴量ベクトルを生成し,教師データとして用いた.この計測指向型機械学習アルゴリズムの開発により,多数の特徴量を効果的に波形識別に活用できるようにし,実際にインフルエンザやコロナウイルスを含む5種ウイルスを1個の電流パルスから71 %以上の精度で識別可能であることを実証した.ここで,この数値は単一ウイルスの識別精度であることを強調したい.つまり,実際の検査で複数個のウイルスが検出される場合,識別精度は二項分布に従い個数の0.5乗に依存して上昇し,例えば9個のウイルスが計測されれば90%以上の精度でのウイルス同定も可能になるのである.
5. むすび
ナノポアセンサは抗体分子を不要とせず,簡単な電流計測で生のウイルスを検出することから,未知な新型ウイルスであっても問題なく検出して適格にその物理特性の違いを見分けることができるだろう.これは,実際にインフルエンザの亜種が識別できている事実6)によって裏付けられた予想である.また,機械学習による波形識別は汎用のCPU(Central Processing Unit)でもミリ秒で完了でき,ウイルスもミリ秒足らずでナノポアを通過することから,検出・識別はほぼリアルタイムに遂行できる.なにより,ナノポアセンサが普及するほど学習データ量は増し,もたらされるビッグデータによって識別精度が上がるポテンシャルまで備えている.近い将来,本技術が広くウイルス検査に応用されることで,人の安全・健康に貢献できるであろう.
謝辞
本結果は,内閣府ImPACTプログラム「進化を超える超微量物質の超迅速多項目センシングシステム」の成果である.
文献
- 1) W. Zhang and R. G. Webster: Science 357, 111 (2017).
- 2) Y. Fang, H. Zhang, J. Xie, M. Lin, L. Ying, P. Pang, and W. Jing: Radiology(2020) [DOI:10.1148/radiol.2020200432].
- 3) M. Tsutsui, S. Hongo, Y. He, M. Taniguchi, N. Gemma, and T. Kawai: ACS Nano 6, 3499 (2012).
- 4) M. Tsutsui, Y. He, K. Yokota, A. Arima, S. Hongo, M. Taniguchi, T. Washio, and T. Kawai: ACS Nano 10, 803 (2016).
- 5) M. Tsutsui, T. Yoshida, K. Yokota, H. Yasaki, T. Yasui, A. Arima, W. Tonomura, K. Nagashima, T. Yanagida, N. Kaji, M. Taniguchi, T. Washio, Y. Baba, and T. Kawai: Sci. Rep. 7, 17371 (2017).
- 6) A. Arima, M. Tsutsui, I. H. Herlisa, T. Yoshida, M. Tanaka, K. Yokota, W. Tonomura, M. Taniguchi, M. Okochi, T. Washio, and T. Kawai: Sci. Rep. 8, 16305 (2018).
- 7) M. Tsutsui, K. Yokota, A. Arima, Y. He, and T. Kawai: ACS Sens. 4, 2974 (2019).
- 8) M. Tsutsui, T. Yokota, T. Nakada, A. Arima, W. Tonomura, M. Taniguchi, T. Washio, and T. Kawai: ACS Sens. 3, 2693 (2018).
- 9) M. Tsutsui, K. Yokota, T. Yoshida, C. Hotehama, H. Kowada, Y. Esaki, M. Taniguchi, T. Washio, and T. Kawai: ACS Sens. 4, 748 (2019).
- 10) M. Tsutsui, T. Yamazaki, K. Tatematsu, K. Yokota, Y. Esaki, Y. Kubo, H. Deguchi, A. Arima, S. Kuroda, and T. Kawai: Nanoscale 11, 20475 (2019).
- 11) A. Arima, I. H. Herlisa, T. Yoshida, M. Tsutsui, M. Tanaka, K. Yokota, W. Tonomura, J. Yasuda, M. Taniguchi, T. Washio, M. Okochi, and T. Kawai: J. Am. Chem. Soc. 140, 16834 (2018).
- 12) 筒井真楠,鷲尾隆,川合知二:科学雑誌NEWTON 3月号 p.15 (2019).


