特別WEBコラム 新型コロナウィルス禍に学ぶ応用物理 次世代検査/評価技術 局在・表面プラズモン共鳴 羅希,寺田侑平,齋藤真人 大阪大学
1. まえがき
中世ヨーロッパの教会で見られるルビー色のステンドグラスや金赤の江戸切子に金が使われていることをご存知だろうか?この赤い色は金のナノ粒子によって発色され,長い間色褪せず美しい色を保っている1).それだけでなく,実は病気の診断にも金ナノ粒子は使用されていて,鼻水,唾液,尿などの検体液を膜に滴下するだけで感染症やストレス,妊娠などの有無を見分けることができるイムノクロマトグラフィーという手法である.図1に示すように,検体中の抗原が検体滴下部に予め用意された金などのコロイド粒子で標識された抗体と複合体を形成しながら,スポンジ状のセルロース膜内を毛細管現象で流れていく.次いで膜上のテストラインに固定された抗体上に複合体が捕捉され,コロイド粒子が凝集することで程色し,それを目視により判定することができる.身近なところではインフルエンザや溶連菌,妊娠ホルモンの検出などに使用されている.

2. プラズモンを用いたバイオセンサー
金属は自由電子が豊富であり,金属中をまるでプラズマのように電子が行き来している.特に表面に着目してみると電子が集団で振動し,表面を伝搬する波として存在する.これを表面プラズモンと呼び,金属表面に光を照射すると表面プラズモンと入射光の金属表面に平行な成分が共鳴(図2a),すなわち表面プラズモン共鳴(Surface Plasmon Resonance : SPR)が起きる.さらにナノ粒子のように金属のサイズをナノレベルまで小さくすると金属ナノ構造で分極が起こる(図2b).この現象の際,プラズモンはナノ構造近傍に局在化するため,局在表面プラズモン共鳴(Localized Surface Plasmon Resonance : LSPR)と呼ぶ2,3).このとき,例えば40 nm程度の金ナノ粒子であれば,青や緑の波長が吸収されるため,赤色に見えるのである.

(c) LSPRバイオセンシングの例.
ここで,バイオセンサーとは,抗体など生体由来の優れた分子認識機能を利用して対象物質に特異的に結合させ,その変化量を変換素子の性質を介して電気信号にして取り出すことで計測を行うセンサーの総称である4,5).ではSPR/LSPR技術をどのようにバイオセンサーへ応用するのか?金属に物質が吸着すると金属表面近傍の屈折率が変化するが,同時にプラズモン共鳴が生じる周波数も変化する.SPR/LSPRバイオセンサーではこの時に生じる吸収,透過,または反射等のスペクトル変化を測定することで金属表面における病原体吸着を検出する.特にSPRバイオセンサーは高感度検出が可能であり,また生体分子間の相互作用について動的な情報を評価するのにも優秀である.一方,LSPRバイオセンサーは比較的小型かつ簡便な測定系での検出が可能であり,簡易迅速検査(Point of Care Testing : POCT)への応用が期待されている6,7).そのため新型コロナウイルスの流行を考えると,LSPRを用いた手法は大いに注目できるだろう.代表的な例では,生体分子が金ナノ構造の表面に結合した際の屈折率変化により生じる吸収スペクトルのピークシフトを利用している(図2c).
3. LSPRバイオセンサーの進展
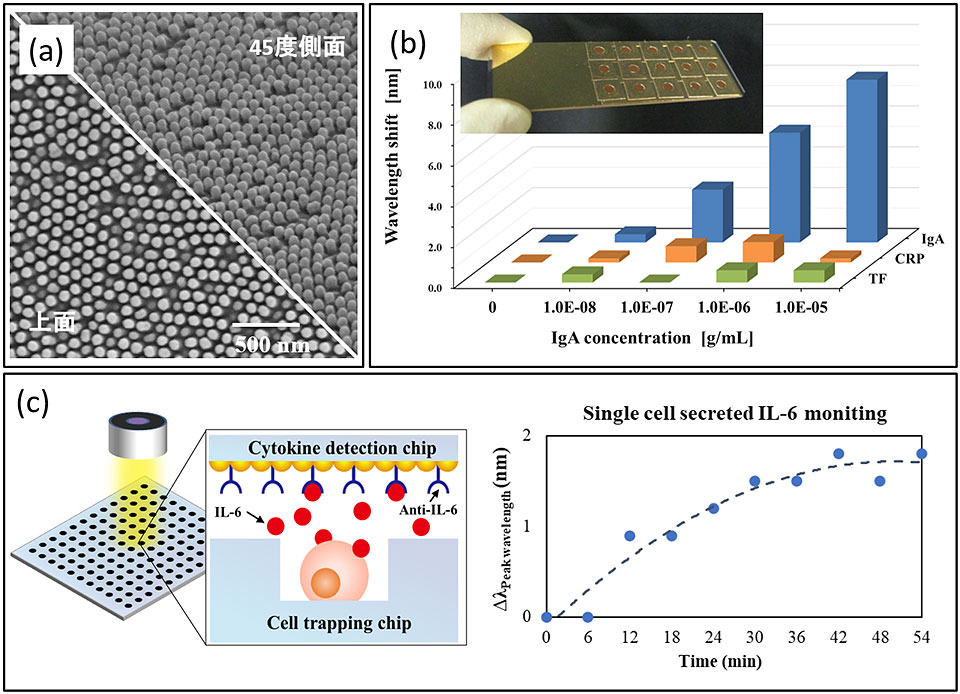
POCT指向のバイオセンサーの研究にあたっては,低コストで量産性に優れた金属ナノ構造体を用いたセンサーチップの作製が求められる.我々は低コストかつ高スループットでナノパターンを転写できるナノインプリントリソグラフィ(nanoimprint lithography : NIL)技術に金薄膜形成技術を組み合わせてLSPR計測が可能な金キャップナノピラーチップを開発してきた(図3a)8,9).LSPRの利点としては,主に手のひらサイズの分光器と白色光源を用いて,チップに照射された光の反射や吸光度のスペクトルピークシフトを計測するだけでチップ上へのタンパク質吸着をラベルフリーに特異検出することが可能である.開発したセンサーチップは1 ng/mLの高感度検出が可能であり,類似するAuナノロッドを用いたセンサーと比べて100倍以上の検出感度を達成している8).
一方,1つのチップ内で複数項目を同時計測できれば,バイオセンサーとしての付加価値は高くなる.例えば免疫活性因子やがんマーカー,アレルギー,毒素など医療関連分野においてはそのニーズは高い.我々は,チップ上に形成された複数の金キャップナノピラーのスポットを同時に計測可能なハイパースペクトルイメージングに注目し,これを利用した多項目同時LSPR計測も可能にしている.これは可変フィルターを介して単一波長順に光を透過させ,その強度をCCDカメラにて順次記録していくことで,波長ごとの2次元分光画像を取得するものである.ピクセルごとにスペクトルを得ることができるため,面内にあるセンサースポット毎の吸収スペクトルおよびそのピーク位置変化を追うことで複数スポットにおける免疫グロブリンA吸着の同時計測が達成された(図3b)10).
一方,COVID-19によって引き起こされるサイトカインストームでは,免疫細胞がウイルスと戦うために作る様々なサイトカインの放出が制御不能となって免疫暴走するために起こるが,このとき個々の細胞がどのような状況に陥っているかを調べることが重要である.そこで,免疫細胞を1個ずつ捕捉し,個々の細胞からの分泌物解析を同時におこなうことが可能なLSPRバイオセンサーも開発した11-13).マイクロウェルに白血球細胞株を捕捉し,代表的なサイトカインの一つであるIL-6を近傍の金ナノ構造に抗原-抗体反応により捉えて,IL-6濃度分布の経時変化解析ができた(図3c).
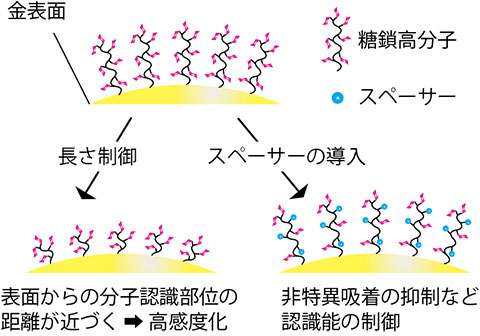
最近,さらなる取り組みとして,標的を捕捉するバイオインターフェイスの部分を精密制御することでLSPRバイオセンサーの高感度化に取り組んでいる.金表面への物質吸着飽和による吸収ピークシフト量をλmax,バルク屈折率感度をm,屈折率変化をΔn,金表面のリガンド層の膜厚をd,電磁場の減衰長をldとすると,下記の式が成り立つ14).
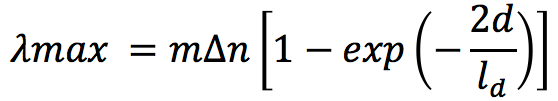
そのため,薄い膜厚で認識特異性の高いリガンド層を作ることが重要な課題となる.そこでサイトカインの人工的なリガンドとして微小抗体や糖鎖高分子の採用を検討している.特に糖鎖高分子は近年の重合技術の発展に伴って,ナノメートルオーダーでのサイズ制御が可能である.さらにスペーサー等を導入することで認識能を変化させることも可能である(図4).我々上記の人工材料により精密制御されたリガンド層を設計し,それぞれのバイオインターフェイスを用いた場合のサイトカイン検出感度について検討を進めている.
(c)単一細胞分泌サイトカインの検出チップ.
4. むすび
最近発表された研究では,特定のウイルスRNA配列を認識できるLSPRバイオセンシングシステムが開発され,新型コロナウイルスの選択的検出も可能となり,臨床応用も期待されている15).病原菌の検出や,疾患原因の細胞レベルの追求など,LSPRバイオセンサーにかかる期待は大きいと考えられる.高感度化や高集積化などの課題を進展させ,健康や安全安心など人・社会に貢献できるよう努力していきたい.
謝辞
この研究の一部は,産総研・阪大先端フォトニクス・バイオセンシングオープンイノベーションラボラトリと国立研究開発法人科学技術振興機構(JST)戦略的創造研究推進事業(CREST) No.JPMJCR16G2の支援を受けた.
文献
- 1) 山口晃:色材協会誌 52, 642(1979).
- 2) 梶川浩太郎,岡本隆之,高原淳一,岡本晃一:アクティブ・プラズモニクス(コロナ社,2013)
- 3) 岡本隆之,梶川浩太郎:プラズモニクス-基礎と応用(講談社,2010)
- 4) 鈴木 周一編: “バイオセンサー”,講談社(1984).
- 5) 軽部 征夫,民谷 栄一: “バイオエレクトロニクス”,朝倉書店(1994).
- 6) K.M. Mayer, J.H. Hafner: Chemical Reviews. 111, 3828-3857 (2011).
- 7) K.A. Willets, R.P. Van Duyne: Annual Review of Physical Chemistry. 58, 267-297 (2007).
- 8) M. Saito, A. Kitamura, M. Murahashi, K. Yamanaka, L.Q. Hoa, Y. Yamaguchi, E. Tamiya: Analytical Chemistry. 84, 5494-5500 (2012).
- 9) S. Jiang, M. Saito, M. Murahashi, E. Tamiya: Sensors and Actuators B-Chemical. 242, 47-55 (2017).
- 10) H. Yoshikawa, M. Murahashi, M. Saito, S. Jiang, M. Iga, E. Tamiya: Analytical Methods. 7, 5157-5161 (2015).
- 11) R.A. M. Ali, W.V. Espulgar, W. Aoki, S. Jiang, M. Saito, M. Ueda, E. Tamiya: Japanese Journal of Applied Physics. 57, (2018).
- 12) R.A. M. Ali, D. Mita, W.V. Espulgar, M. Saito, M. Nishide, H. Takamatsu, H. Yoshikawa, E. Tamiya: Micromachines. 11, (2020).
- 13) C. Zhu, X. Luo, W.V. Espulgar, S. Koyama, A. Kumanogoh, M. Saito, H. Takamatsu, E. Tamiya: Micromachines. 11, (2020).
- 14) L. S. Jung, C. T. Campbell, T. M. Chinowsky, M. N. Mar, S. S. Yee: Langmuir, 15, 5636-5648 (1998).
- 15) G.G. Qiu, Z.B. Gai, Y.L. Tao, J. Schmitt, G.A. Kullak-Ublick, J. Wang: Acs Nano. 14, 5268-5277 (2020).


