特別WEBコラム 新型コロナウィルス禍に学ぶ応用物理 新型コロナウイルス迅速検査(蛍光LAMP法) 後藤浩朗 キヤノンメディカルシステムズ株式会社
1. まえがき
「彼を知り己を知れば百戦危うからず」.孫子の兵法ではないが,何よりも初動が肝要,といわれる感染症対策では,原因微生物を迅速,正確に測定することが重要である.キヤノンメディカルシステムズ(株)では,20年前(当時,(株)東芝)より独自技術を用いた電流検出型DNAチップの事業化に取り組んできた.挿入剤を用いて電気化学的に複数の遺伝子を同時に短時間で検出できる特長を生かし,これまでにコメ品種識別やBRDC(Bovine Respiratory Disease Complex:牛呼吸器病)カードを実用化してきた1).このシステムの遺伝子増幅法はPCR(Polymerase Chain Reaction)法ではなく,等温増幅法のLAMP(Loop-Mediated Isothermal Amplification)法を採用している.
2014年,西アフリカにおけるエボラ出血熱アウトブレイクの際,長崎大学の安田二朗教授らと検査システムの開発に取り組むことになったが,DNAチップは一度に多項目を検出できるものの検査に2時間要するため,ここでは1ターゲットを迅速,高感度に検出できるシステムが求められた.さまざまな技術を検証した結果,蛍光LAMP法を用いたGenelyzer Fシリーズ(図1)を実用化した.感度はPCR法と同程度,検査時間は約15分と迅速,装置は約2kgと小型軽量,バッテリ駆動であることもギニア共和国で高く評価され,外交を通じ,全州計9式が緊急支援として配備された.2016年には,本システムを応用し,国立感染症研究所の研究事業でジカ熱ウイルス診断キットを開発,2018年6月に体外診断用医薬品の承認(製造販売承認番号;23000EZX00035000)を得た.2020年2月,ブラジルでのジカウイルス感染症対策に共に取り組んだ国立感染研の長谷川秀樹先生から新型コロナウイルス迅速検査キットの開発要請があり,長崎大と開発に着手,国の性能評価を経て3月26日に実用化に至った.

左:GenelyzerFIII(8反応/Run),右:GenelyzerFII(16反応/Run)
2. LAMP法と蛍光LAMP法
LAMPとは,Loop-Mediated Isothermal Amplificationの略であり,栄研化学(株)が開発した迅速,簡易,精確な遺伝子増幅法である2).標的遺伝子の6つの領域に対して4種類のプライマーを設定し,鎖置換反応を利用して一定温度で反応させることを特徴としている.サンプルとなる遺伝子,プライマー,鎖置換型DNA合成酵素,基質等を混合し,一定温度(65°C付近)で保温することによって反応が進み,検出までの工程を1ステップで行うことができる.新型コロナウイルスのようにターゲットがRNAウイルスの場合は前述の試薬に逆転写酵素を追加,混合することによってRNAからcDNAを合成して増幅・検出する(RT (Reverse Transcription)-LAMP法).LAMP法詳細については栄研化学ホームページを参照されたい.
http://loopamp.eiken.co.jp/lamp/index.html
蛍光LAMP法では,蛍光色素として二重鎖DNAと特異性高く結合するシアニン系色素を用いている.このシアニン系色素はデオキシリボ核酸の平面上の塩基に挿入され,リン酸基と静電気的に結合(インターカレーション)すると,青色光で励起され緑色光の蛍光を発する特徴を持っている.LAMP法により増幅されたDNAに蛍光色素を結合させ,励起光を照射,蛍光を経時的に検出することで,増幅をリアルタイムに測定する.図2は蛍光LAMP増幅曲線で,検体毎の蛍光強度の時間変化を表しており,蛍光強度が急峻に増加して検体が陽性を示している.

PCR法では,増幅の際に反応温度を上下させる必要があるが,LAMP法は等温で増幅反応を行うため短時間で検査結果を得ることができる.等温増幅法にはLAMP法やSDA法などがある3).LAMP法では,増幅反応時に産出される副産物ピロリン酸マグネシウムに光を透過させて濁度(吸光光度)を測定する.蛍光LAMP法では蛍光物質を用い,励起光を照射し蛍光強度をリアルタイムに測定することにより,より迅速な測定を実現している.新型コロナ迅速検査法として厚労省,国立感染研から認められた等温増幅法にはLAMP法,蛍光LAMP法の他,独自の蛍光プローブを用いたSmartAmp法がある.(https://www.niid.go.jp/niid/images/lab-manual/2019-nCoV-17-20200326.pdf)
3. 新型コロナウイルスRNA検出試薬Genelyzer KIT
3.1 性能
本試薬は,3月に国立感染研のパネル検体を用いた性能評価の結果,陰性一致率100%(45正答/45検査),陽性一致率93%(28/30)であった.検査時間は20分,おおよそ10分以内にSARS-CoV-2遺伝子を検出した.感度は,15ウイルスゲノムコピー/反応付近以上の検体については100%(27/27),速いものは6分程度で検出した.
3.2 検査の方法
- (1) プライマー,Isothermal Master Mix,逆転写酵素などの試薬類を専用の反応チューブに準備する.
- (2) 検体から抽出したRNA抽出液及び陽性コントロール,陰性コントロールを反応チューブに5µℓ添加する.
- (3) 反応チューブのフタをしっかり閉めた後,泡を立てないように溶液を軽く撹拌(かくはん)し,スピンダウンを行う.
- (4) 気泡が入ってしまった場合は気泡が消えるまでスピンダウンを行い,外側に水滴,霜などが付着した場合は,しっかりと拭き取り,装置にセットする.
- (5) 専用プロファイルを選択し,スタートボタンを押し検査を開始する.
3.3 測定方法
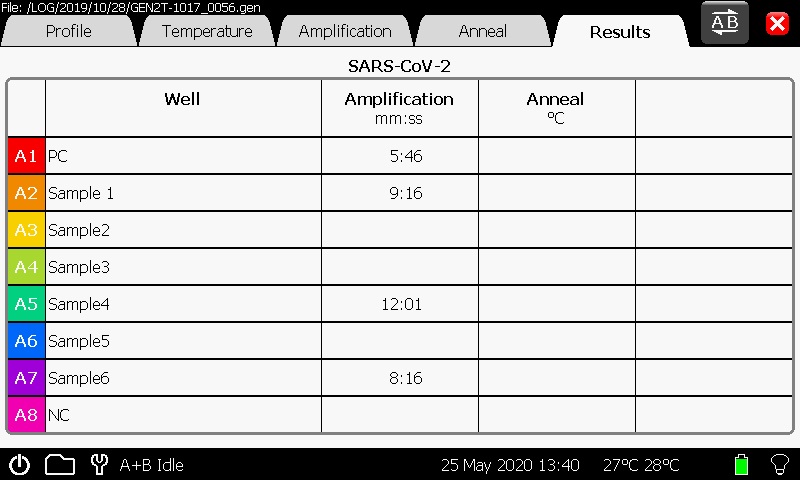
陽性反応を示した時間が画面に自動的に表示される.図3は結果画面であり,陽性検体の場合は「Results」欄に増幅開始時間(分:秒)が表記され,陰性検体の場合は時間が表示されない.また「Amplification」欄で蛍光値の波形を確認し,ノイズ等による時間表示ではないことをチェックし判定する.
3.4 非特異反応について
遺伝子検査においては非特異反応との識別が求められる.非特異反応は,測定対象の何らか生体成分が試薬や他の添加物などの成分と反応を引き起こし,本来陰性を示すべき測定対象と異なる測定値を示す,つまり偽りの結果(偽陽性)を示す現象である.蛍光LAMP法ではアニーリング解析注)を用いることにより識別可能である.なお,本試薬は,開発段階で近縁種であるSARSとの特異性の実証試験などを積み重ねた結果,非特異増幅反応が見られなかったため,検査プロファイルからアニーリング解析プログラムは外している.
注:アニーリング解析
→結合した二本鎖DNAを一度加熱し解離させた後,温度を下げていくと二本鎖が再び会合(アニール)し,蛍光色素が再び取り込まれ,蛍光を発する.増幅長ごとに会合温度は異なることを利用し,非特異的に増幅されたDNAとの識別のため,蛍光強度が最大になる会合温度を解析する方法.
4. 大型クルーズ船「コスタ・アトランチカ号」
4月,修繕のため長崎に停泊したコスタ・アトランチカ号の船内で新型コロナウイルスの集団感染が発生した.拡大防止のためには全容把握が重要であり,まずは乗組員全員の遺伝子検査が求められた.長崎県は乗組員623人全員を対象にウイルス検査を行うことを決め,この依頼を受けた長崎大学は,安田教授らを中心に蛍光LAMP法を用い,わずか4日あまりで全員検査を完遂した.最終日は一日に280人分を検査,感染者は149人を数えた.結果を踏まえ,県は2次感染防止策に着手,エビデンスベースの的確,迅速な措置が功を奏し,その後事態は速やかに収束した.5月末,運航のために残った乗組員126名の陰性も確認され,条件が整ったことから5月31日に無事,長崎港を離岸,出港した.なお,乗組員の陰性確認検査にも蛍光LAMP法が利用された.
長崎県内は8医療圏に区分されている.離島が多く,患者や検体の移動に際して天候要因などに影響を受けやすい土地柄である.長崎県は「1医療圏に1台以上」を目安に,各医療圏内で新型コロナウイルスの行政検査を実施,自己完結しうる分散処理型の検査体制を既に整備し,第2波に備えている.
5. むすび
6月,唾液検体による検査が認められた.検体採取が容易になることから,これまで躊躇われてきた軽症,無症状者への検査や陰性証明など検査の間口,機会が広がるものと期待されている.蛍光LAMP法ならではの迅速,高感度,モバイル可能な特長を活かし,例えば,空港検疫の迅速化やスポーツなど大規模イベントでの陰性証明,介護施設などへの巡回検査など,社会のニーズに寄り添った検査機会を創出,提供していきたい.
21世紀に入り成長著しいバイオの分野であるが,この成長を支えているのは,バイオテクノロジーとナノテクノロジーをはじめとする異分野との融合,その融合により生まれるイノベーションである.我々も1992年に電流検出方式を発明以来,「血液1滴で感染症検出から発現解析まで可能なセンサー」の開発,実用化を目指し,生物・バイオ領域だけでなく,電機メーカならではのエレクトロニクス領域,例えばCMOS(Complementary Metal Oxide Semiconductor),ナノポアなどの半導体技術を活用したセンシング技術,自動化技術や部品・材料などさまざまな研究開発テーマを駆使して取り組んできた.現時点では,実用化はその一部に留まり,ほとんどの応用技術は未だ「死の谷」を超えていない.
目に見えないウイルス,感染症は人々の恐怖感を助長し,悪戯に社会不安を募る.これに立ち向かうためには,社会全体での対応が求められる.今,我々にできることは,まずは蛍光LAMP法の社会実装を推進し,感染状況の「見える化」に少しでも寄与することである.一方,感染症対策の高度化に向けて,より簡便な前処理・抽出法や迅速・高感度なデバイスなどの新技術の研究・開発を決して手を止めずに紡ぐ覚悟が求められる.新型コロナウイルス禍がもたらす社会不安の緩和,払拭のため,そして明日のために,微力ながら,モノづくり企業ならではの視点で感染症対策の一隅を照らすべく尽力していく所存である.
謝辞
本開発に関してご協力いただきました以下の方々に心より感謝申し上げます.
長崎大学熱帯医学研究所 安田二朗教授,
吉川禄助先生,
国立感染症研究所 長谷川秀樹先生,
厚生労働省 林修一郎様,
文部科学省 岩﨑容子様,
長崎県 長谷川麻衣子様,
国立保健医療科学院 齋藤智也先生,
故竹内勤先生
文献
- 1) 後藤浩朗,石川正行,高橋匡慶,宇留野勝好:JATAFF ジャーナル 8, 3 (2020).
- 2) Notomi T, Okayama H, Masubuchi H, Yonekawa T, Watanabe K, Amino N, Hase T. Nucleic Acids Res.; 28, 12 (2000)
- 3) 山形光一:Sysmex Jounal Web Vol.2 No.2 (2001)
- 4) 長崎新聞,2020年4月26日
https://this.kiji.is/626987274190652513?fbclid=IwAR2eeHecwLztqz7zc3aZwvObni-VXNaZJryI_Kjuoh5CgXoSkra3YXKrhmo
