特別WEBコラム 新型コロナウィルス禍に学ぶ応用物理 顕微鏡によるウイルス観察 永山 國昭 N-EMラボラトリーズ株式会社 ,山口 正視 千葉大学・真菌医学研究センター
1. まえがき
1880年代病原体としての細菌がロベルト・コッホにより光学顕微鏡(光顕)で特定されて以来,光顕は病理研究の花形機器として広く活用されてきた.その後,ウイルス観察には光顕の分解能を超える機器が必要ということで,電子顕微鏡(電顕)が発明された.事実,1940年にはすでにバクテリアを溶菌するウイルスの電顕写真が撮られ,人々を驚嘆させた1).しかし近年,ゲノム配列解読法の急速な普及により,形態学手法はゲノミックス手法に置き替わり,病理研究の基礎応用両面で顕微鏡利用は大きく後退した.新型コロナウイルス感染の蔓延(まんえん)は,この流れに一石を投じるものであり,TVニュースにおけるウイルス電顕写真は,再び人々の耳目を顕微鏡技法に引き付けているようにみえる.
本コラムでは,ウイルスパンデミック下の形態学研究につき顕微鏡によるウイルス観察の現状をお伝えしたい.
2. 「かたち」を観る
ウイルスの形を見られるだけの解像度を持った顕微鏡は,電顕,Ⅹ線顕微鏡および原子間力顕微鏡である.後者2つは別コラムに譲り,ここでは電顕について紹介する.その電顕ですら透過型と走査型に2大別されるが,病理で多用されるのは前者である.透過電顕による伝統的ウイルス観察には,ウイルス個体を高分解能で見る陰染色法と組織中のウイルス局在を見る組織切片法がある.
光顕でもそうだが,一般に生物は染色なしにはコントラストがつかずいわば透明である.電顕の生物用染色法として最初に開発されたのが,ウラン染色を用いる陰染色法である.生物由来の有機物が黒いコントラストのウランを背景に白く見えるので陰染色 (negative staining) の名が冠された.TVに紹介されるウイルス画像の多くはこの陰染色像である.直近の文献2より採録した両手法の画像例を図1に載せた.
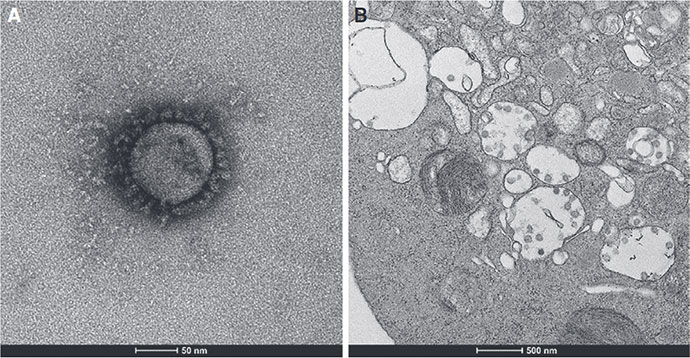
(a) 陰染色像(下段バー:50nm,ウラン染色) (b) 組織切片像(下段バー:500nm,オスミウム染色).
拡大率は陰染色像の10分の1で,空所に散在する微小顆粒がウイルスと同定された.
Reprinted from Med. J. Aust. 212, 459 (2020)., L. Caly, et al. Copyright (2020), with permission from John Wiley and Sons.
米国疾病対策予防センター(Centers for Disease Control and Prevention : CDC)のサイト<https://www.cdc.gov/sars/lab/images.html>には,2003年に流行したSARS(Severe Acute Respiratory Syndrome)ウイルスの電顕像が載っているが,これらを見ると,今回の新型コロナウイルス(SARS-CoV-2)と前回のSARS—CoVは形態的には全く差のないことがわかる.特徴は名前の由来であるウイルス周辺を飾る王冠(corona)状突起である.また大きさもほぼ同じで平均直径は100 nmほどである.なお,国立感染症研究所のサイト<https://www.niid.go.jp/niid/ja/multimedia/9368-2019-ncov.html>にも本稿同様の電顕像が紹介されている.
コロナウイルス一般は脂質膜というエンベロープをもつRNAウイルスで,この型のウイルスに特有の不定形である(インフルエンザウイルスも同様).このことは近年長足の進歩を遂げた電顕手法,単粒子解析の適用が不可であることを意味し,高分解能立体構造解析の道が閉ざされている.これを打開する手法としておなじく近年進展著しいトモグラフィー(図5b参照)があるがいまだ適用されていない.ウイルスそのものではなくウイルスを構成する蛋白質に限れば高分解能構造研究が電顕単粒子解析で行われている.図2は新型コロナウイルスRNA合成酵素の立体構造である(2.9Å分解能)3).
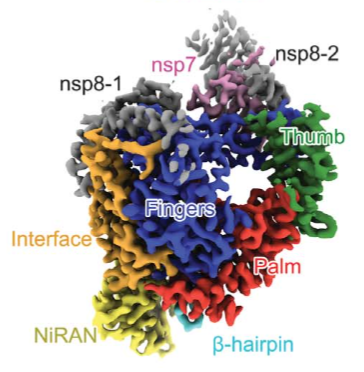
Reprinted from Y. Gao et al., Science 368, 779 (2020).
Distributed under a CC BY 4.0 license (https://creativecommons.org/licenses/by/4.0/).
これは抗ウイルス薬として2020年5月に特例承認されたレムデシビルの標的酵素であり,その構造解析は薬効向上のために役立つとされている.この例にとどまらず電顕単粒子解析は新型コロナウイルス感染に関わる各種蛋白質の構造解明に広く利用されており,ウイルス表面の細胞吸着スパイク蛋白質の構造も明らかになっている4).これら形態学的情報は感染防止のための抗体創薬研究に基盤を与えており,電顕の応用範囲を拡大した.
他方,先に紹介した陰染色法や組織切片法は50年以上前の電顕技術であり,分解能が十分でないため像だけからウイルスの種別まで判定するのは困難である.陰染色像も表面コロナという特徴でかろうじて正解を得ているが,図1bのような画像では,大きさ以外に新型コロナウイルスの特徴を抽出できず,何か他の情報が必要である.この問題を打開するのが光顕手法との組み合わせである.それを次に紹介しよう.

(a) ウイルス蛍光抗体による感染部位特定(白い発光部位)(白バー:50µm)
(b) (a)と同等部位の低拡大組織切片電顕像(囲みcは図4cに拡大)
Reprinted from Lamers et al., Science 369, 50 (2020).
Distributed under a CC BY 4.0 license (https://creativecommons.org/licenses/by/4.0/).
3. 「はたらき」を観る
顕微鏡そのものが医学生物学にとり革命だったが,染色が必要なため長い間生きた状態の細胞を観ることはできなかった.染色で細胞は死滅するからである.生物のはたらきを生きたまま捉えられる位相差顕微鏡は,染色なしで高いコントラストを実現し,1950年代第2の革命をもたらした.そして第3の革命が進行中である.蛍光蛋白質活用の蛍光顕微鏡法は,生きた細胞の中の観たい対象だけを高感度で抽出可能とし,細胞機能の可視化に成功した.まさにはたらきを観る顕微鏡である.
蛍光蛋白質蛍光顕微鏡法の新型コロナウイルスへの適用いまだ報告されていないようだが,同様の主旨の蛍光顕微鏡法として50年以上前に開発された蛍光抗体法が新型コロナウイルス観察に使われている.ウイルスを構成する蛋白質に特異的に結合する抗体に蛍光剤をラベルし可化する技法である.蛍光抗体としては,例えばウイルスRNA核蛋白質と結合する抗体が使われる.図3aは人工小腸のSARS-CoV-2感染過程を蛍光抗体法で追跡した事例である5).
図3aが約200µm直径の人工小腸断面の蛍光顕微鏡像である.緑の蛍光はアクチン繊維の局在を示すphalloidin染色,白がウイルス局在を示すRNA核蛋白質の蛍光抗体染色である.対応する部位の光顕並み拡大率電顕像が図3bであるが,もちろんウイルス像は見えない.しかし,光顕による存在証明に勇気を得て像を拡大していくとウイルス様の顆粒が見えてくる(PCRによる確認も行っている).図4に結果を示した.図4cは図3cの拡大で,その一部fを拡大したのが図4f,さらにその一部gを拡大したのが,図4gである.この多段の拡大でついにウイルスらしき像が見えてきた.しかし,この解像度では図1aに見られるような表面コロナが明瞭には確認できない.組織切片法の高分解能化への脱皮が必要と思われる.その方向の試みとして重金属染色手法の革新,サンドイッチ法による急速凍結・凍結置換法(試料を急速凍結し有機溶媒に浸漬し低温条件でゆっくり重金属染色)が提案されている6).
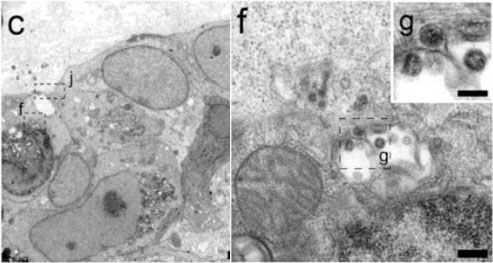
(c) 図3b内囲みcの拡大像
(f) 図4c内囲みfの拡大像(黒バー:250nm) (g) 図4f内囲みgの拡大像(黒バー:100nm)
Reprinted from Lamers et al., Science 369, 50 (2020).
Distributed under a CC BY 4.0 license (https://creativecommons.org/licenses/by/4.0/).
4. むすび:-新技術の展望-
ここで紹介した古典的生物電顕法,陰染色法と組織切片法は,ともにコントラスト付加のために重金属染色を使う.そのため生体の構造が原子分解能レベルでは破壊されているのではとの疑問が呈されてきた.そこで,ほとんど透明な無染色試料にもコントラストを付加できる位相差光顕の電顕版,位相差電顕の開発が数十年来続けられてきた.結局今世紀に入り,帯電問題という電子線特有の積年課題を解決することで電顕位相差法は一応の完成を見た7)
しかし位相差電顕技術だけでは,生物電顕の革新は完結しなかった.2017年ノーベル化学賞に輝いた生試料急速凍結技術の補強が必要であった.急速凍結法は試料の凍結破壊を回避し高分解能を保証する手法として現行の電顕単粒子解析法全てに採用されている.我々も10年以上前に位相差電顕法と急速凍結法を組み合わせ,生体系の高分解能電顕撮影を試みた.図5はインフルエンザウイルスに応用した1例であり,無染色ながら高いコントラストと解像度を実現している.インフルエンザウイルスやコロナウイルスのような不定形ウイルスに対しては,現在に至るまでこれを超える画質のウイルス像は得られていないが,ごく最近,preprint serverに新型コロナウイルスの感染現場を映す低温電顕トモグラフィー(Cryo-ET)像が報告された10). 新技術の威力が充分発揮され,感染細胞中のウイルス増殖過程が臨場感を持った実像として再現されている.是非ご一読いただきたい.

(a) ゼルニケ位相差像(2次元,白バー:20nm)8)
(b) 位相差低温電顕トモグラフィー像(白バー:20nm)9)
Reprinted from J Struct Biol. 2008 May; 162 (2) : 271-6., M.Yamaguchi, R.Danev, K.Nishiyama, K.Sugawara, K.Nagayama. Copyright (2008), with permission from Elsevier.
文献
- 1) H. Ruska; Über die Sichtbarmachung der bakteriophagen Lyse im Übermikroskop. Naturwissenschaften. 28 45 (1940).
- 2) L. Caly, et al.; Isolation and Rapid Sharing of the 2019 Novel Coronavirus (SARS-CoV-From the First Patient Diagnosed With COVID-19 in Australia, Med. J. Aust. 212, 459 (2020).
- 3) Y. Gao, et al.; Structure of the RNA-dependent RNA polymerasefrom COVID-19 virus, Science, 368,779 (2020).
- 4) D, Wrapp et al.; Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science 367, 1260 (2020)
- 5) M. M. Lamers et al.; SARS-CoV-2 productively infects human gut enterocytes, Science, 369,50 (2020)
- 6) M. Yamaguchi et al.; Good Ultrastructural Preservation of Human Tissues and Cultured Cells by Glutaraldehyde Fixation, Sandwich Freezing, and Freeze-Substitution, Cytologia 85, 15 (2020).
- 7) R. Danev and K. Nagayama; Transmission Electron Microscopy with Zernike Phase Plate, Ultramicroscopy 88, 243 (2001).
- 8) M. Yamaguchi, R. Danev, K. Nishiyama, K. Sugawara and K. Nagayama; Zernike phase contrast electron microscopy of ice-embedded influenza A virus, J. Struct. Biol., 162, 271 (2008).
- 9) R. Danev, M. Yamaguchi and K. Nagayama; 未発表データ.
- 10) S. Klein et al.; SARS-CoV-2 structure and replication characterized by in situ cryo-electron tomography. bioRxiv, June 23, 2020.

